Tepelné děje v plynech
[Edit]Úvod
Plyn v rovnovážném stavu lze charakterizovat: - termodynamickou teplotou - tlakem - objemem - počtem molekul (popřípadě hmotností nebo látkovým množstvím )
Stavová rovnice ideálního plynu
rovnice, která vyjadřuje vztah mezi veličinami, které charakterizují plyn v rovnovážném stavu.
- - Teplota [K]
- - Bolzmannova konstanta = [J.K]
- - molární plynová konstanta = = 8, 31 [JK]
- - počet částic [1]
- - látkové množství = [mol]
- - Avogadrova konstanta = [mol]
- - molární hmotnost = [kg/mol]
- - relativní atomová hmotnost [1]
Stavová rovnice ideálního plynu za stálé hmotnosti
pokud (plyn nepředává ani nebere částice z okolí) tak pro ideální plyn platí vztah
proto můžeme považovat za konstantní. Skutečný plyn lze stavovou rovnicí pro ideální plyn popsat jen při nízkém tlaku a vysoké teplotě.
Avogadrův zákon
Různé ideální plyny o stejném objemu, teplotě a tlaku mají stejný počet molekul.
Tepelné děje v plynech
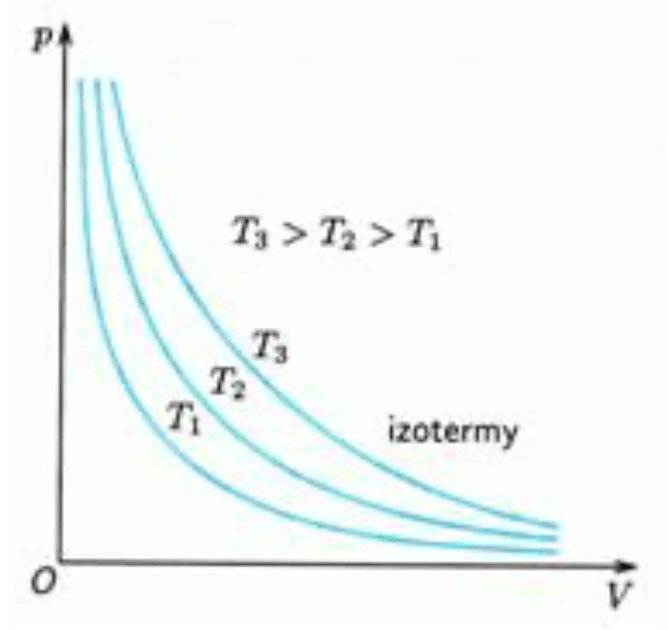
Izotermický děj
- Teplota je konstantní
- V praxi se dá konstantní udržet těžko. Šlo by to ale pomocí termostatu, který by při nepatrné výchylce teploty sepnul ohřívací těleso a to by dodával do plynu teplo.
- Boyleův-Mariotteův zákon:
- Teplo přijaté plynem je rovno práci vykonané, změna vnitřní energie je 0
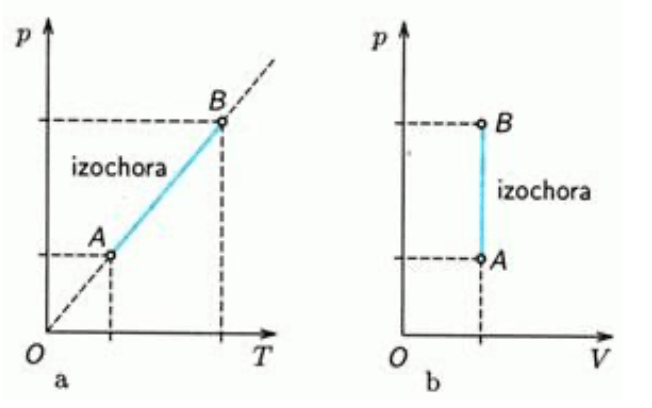
Izochorický děj
- Objem je konstantní
- V praxi se tento děj odehrává v plynu, který je v uzavřeném prostoru např. míč na který svítí slunce.
- Charlesův zákon:
- Teplo přijaté plynem je rovno přírůstku jeho vnitřní energie. Plyn nekoná práci.
- - měrná tepelná kapacita plynu při stálém objemu
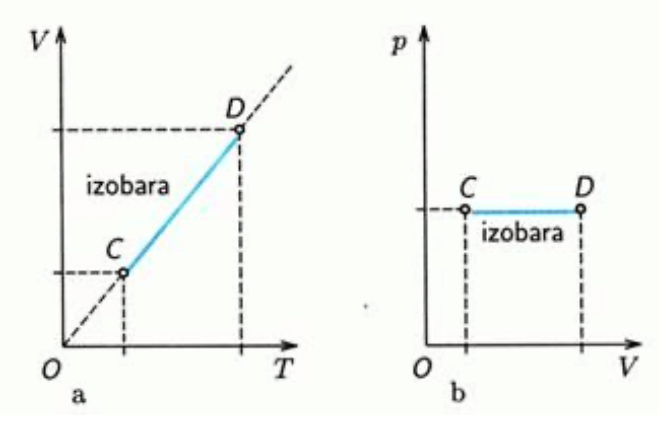
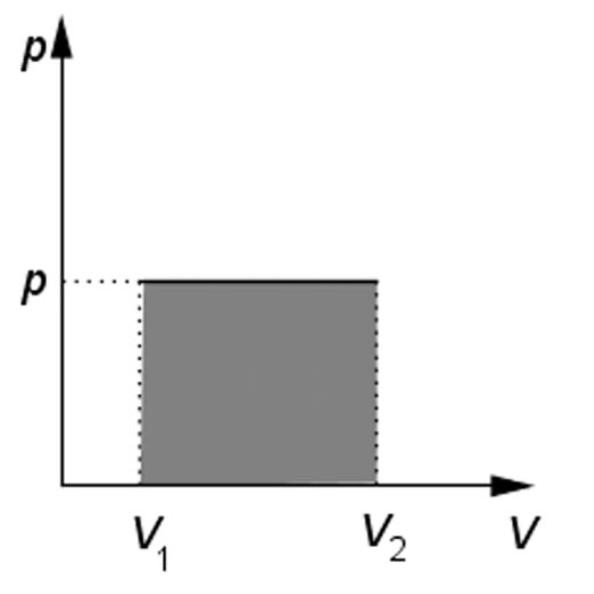
Izobarický děj
- Tlak je konstantní
- Gay-Lussacův zákon:
- Teplo přijaté plynem je rovno součtu přírůstku vnitřní energie a vykonané práce.
- - měrná tepelná kapacita plynu při stálém tlaku
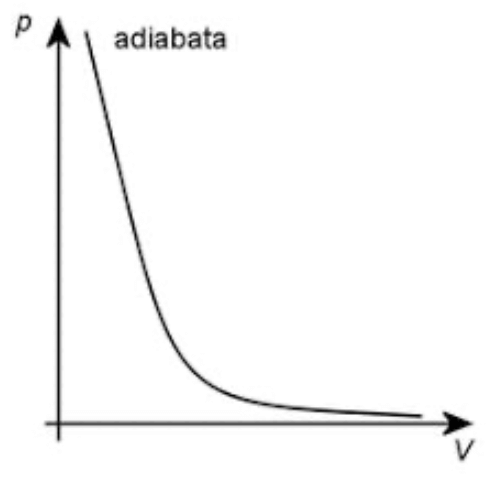
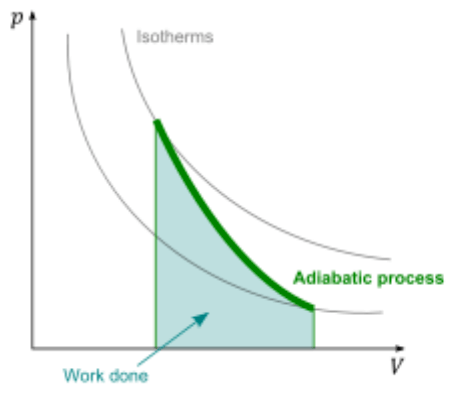
Adiabatický děj
- Neprobíhá tepelná výměna s okolím, což znamená, že
- Boyleův-Mariotteův zákon:
- - Poissonova konstanta =
- - tepelná kapacita při stálém tlaku
- - tepelná kapacita při stálém objemu
- - měrná tepelná kapacita při stálém tlaku
-
- měrná tepelná kapacita při stálém objemu
- Teplo přijaté plynem je rovno 0, vnitřní energie je rovna vykonané práci.
Vykonaná práce
Proměnlivý tlak
Izobarický děj
Kruhový děj
- konečný stav soustavy je roven prvotnímu stavu
- celková změna vnitřní energie je rovna 0
- celková práce vykonaná plynem během jednoho děje je rovna celkovému teplu přijatému
- během tohoto cyklu (práce vykonaná plynem během kruhového děje je znázorněna plochou ohraničenou grafem kruhového děje)
- ohřívač () = těleso, od něhož přijme plyn teplo
- chladič () = těleso, jemuž odevzdá teplo
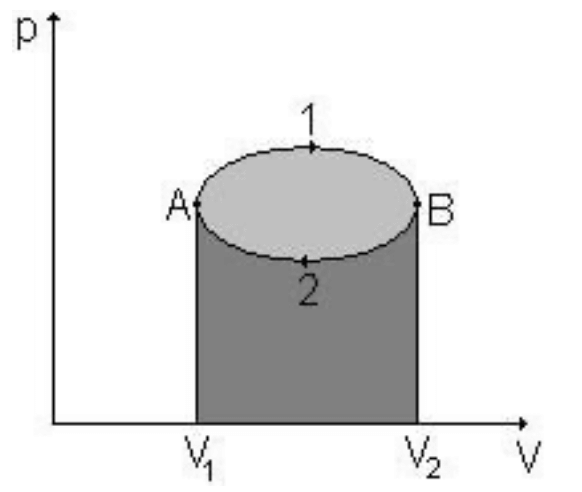
- účinost:
