Elektronový obal atomu
[Edit]Úvod
Elekronovým obalem atomu se zabývá atomová fyzika. Tento obor řeší vlastnosti a pohyb elektronů, jádrem se nezabývá.
Elektrony
- Tvoří elektronový obal atomu
- Obíhají atomové jádro a to jen po několika daných drahách
- Jejich energie není pro danou trajektorii přesně daná a u různých prvků se liší
Spektrum záření
- Soustava spektrálních čar daného plynu je pro každý druh atomů jedinečná. Podle spektra můžeme prvky přesně identifikovat a provádět chemickou spektrální analýzu.
- Spektrální čára je malá výseč spektra optického záření
- Emisní spektra:
- Spojité spektrum - zahřáté těleso (např. Slunce) vysílá elektromagnetické záření všech volných délek
- Čárové spektrum – plyn nebo zahřáté páry kovů, v nichž probíhá elektrický výboj (např. sodíková výbojka, neonka), vysílají záření pouze určitých délek
- Absorpční spektrum – plyny pohlcují záření volných délek, které jinak samy vyzařují
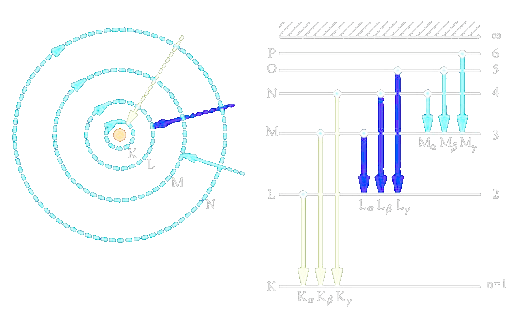
Spektrum vodíku
- Frekvence spektrálních čar vodíku
-
- Rydbergova frekvence = 3,290.10 Hz
-
Jednotlivé série spektrálních čar byly nazvány podle svých objevitelů
- - Lymanova
- - Balmerova
- - Paschenova
- - Brackettova
- - Pfundova
Atom vodíku se může nacházet na určitých energetických hladinách a při přechodu na nižší hladinu vyzáří elektromagnetické záření podle zákona:
- - plankova konstanta
- - frekvence vyzářené fotonu
- - vyšší energetická hladina
- - nižší energetická hladina
Při přechodu z vyšší energetické hladiny na nižší energetickou hladinu vyzáří kvantum energie o frekvenci . Poté dosazením rovnice vyjadřující frekvenci spektrálních čar do rovnice pro energii dostaneme:
a pro atom vodíku:
tato rovnice nám určí energii pro n-tou energetickou hladinu
Ionizace
- Pokud se blíží k nekonečnu, tak energie atomu a vazba je tak malá, že dochází k ionizaci, elektron se stává volným a jeho energie už není kvantová
- ionizace = vytržení elektronu (poté může získat jakoukoliv kladnou energii)
Historické modely atomů
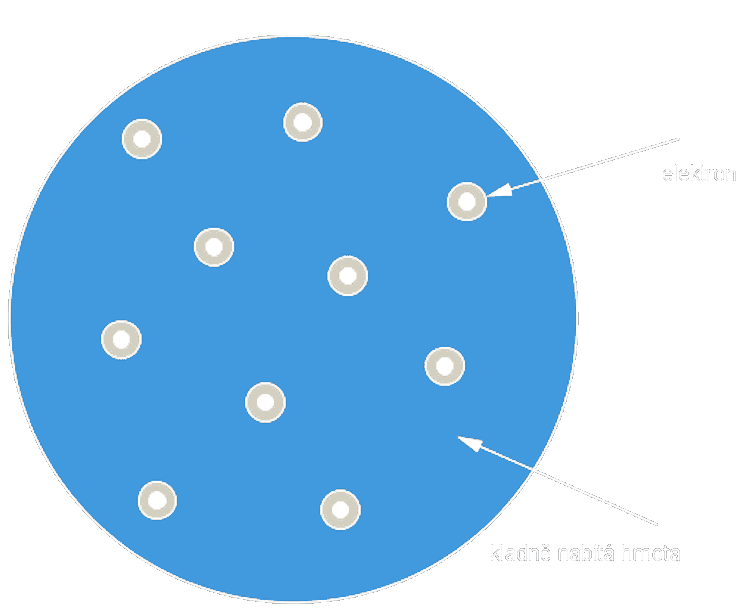
Pudinkový model
- 1897 objevil anglický fyzik Josef John Thompson elektron
- 1906 představil pudinkový model
- elektrony jsou v atomu rozmístěny náhodně
Ruthenfordův model
- novozélandský fyzik Ernest Ruthenford
- odstřeloval tenkou zlatou fólii zářením alfa
- zjistil, že se elektrony se nevyskytují nahodile a že ve středu atomu je velmi malé kladné jádro, které obsahuje kladné částice a nese většinu hmotnosti
- částice pojmenoval protony
- navrhl planetární model
Bohrův model
definován pomocí tří postulátů:
1. postulát
Atom je stabilní soustava složená z nabitého jádra o téměř celkové hmotnosti atomu a elektronového obalu.
2. postulát
Atom se může nacházet pouze v kvantových stavech s určitou hodnotou energie. V takovém stavu atom nevydává ani nepřijímá energii a rozložení elektronů v obalu je neproměnné.
3. postulát
Při přechodu do stavu s nižší energií může atom vyzářit kvantum elektromagnetického záření (foton). Naopak při pohlcení fotonu přejde do vyššího energetického stavu.
- Na každé slupce je maximální možný počet elektronů
- Elektrony blíž k jádru mají nižší energii (proto se zaplňují od slupek nejblíže jádru)
- Slupky:
- slupka K - max. 2 elektrony
- slupka L - max. 8 elektronů
- slupka M - max. 18 elektronů
Schrödingerův model
- Atomy se se nacházejí jen ve stacionárních pozicích s danou energií
- Těmto pozicím odpovídá hustota pravděpodobnosti výskytu
- řešením pro pohyb elektronu je vlnová funkce
- řešením hustoty pravděpodobnosti výskytu je funkce
- Důsledek pro model atomu
- elektrony v obalu se pohybují po orbitalech (kvantových stavech), což je prostor s největší pravděpodobností výskytu elektronu (vyskytovat se tam ale nemusí)
Stav elektronu
Kvantová čísla
stav elektronu je popsán čtyřmi kvantovými čísly:
- Hlavní kvantové číslo -
- přirozené číslo, které rozhoduje o energii elektronu
- popisuje vzdálenost orbitalu od atomového jádra
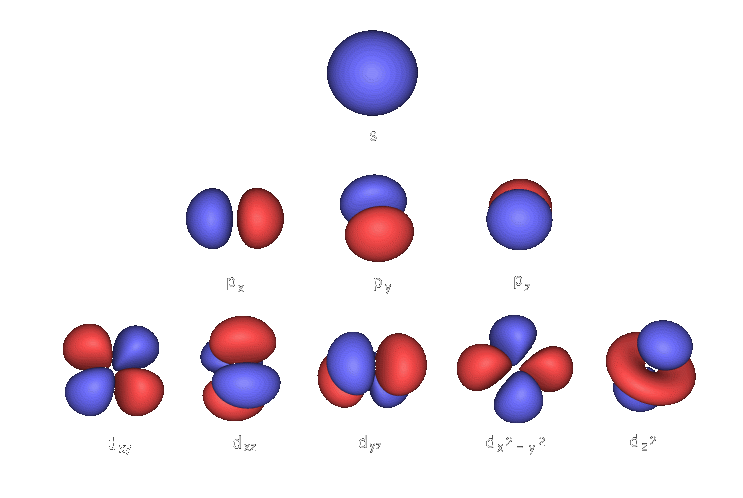
- Vedlejší kvantové číslo -
- často se však používají písmena místo číslic
- rozhoduje o tvaru orbitalu
- Magnetické kvantové číslo -
- celé číslo z intervalu
- rozhoduje o orientaci orbitalu v prostoru
- Spinové magnetické kvantové číslo -
- nabývá pouze dvou hodnot
- elektron představuje magnet, který se může orientovat dvěma způsoby
Stavba elektronového obalu
- 1. Pauliho vylučovací princip
- v daném systému nemohou existovat elektrony ve stejném kvantovém stavu
- to platí pro fermiony (elektron, proton, neutron, …), ale ne pro bosony (foton)
- 2. Hundovo pravidlo
- v orbitalech vznikají elektronové páry až poté co byl každý orbital zaplněn jedním elektronem
- 3. Výstavbový princip
- orbitaly se zaplňují od orbitalů s nejnižší energií
Orbitaly
Záření elektronového obalu
- vyzáření fotonu - elektron přejde ze stavu s vyšší energií do stavu s nižší energií a u toho vyzáří foton
- Druhy záření:
- Viditelné světlo - přechody elektronů ve valenční vrstvě (390 - 760 nm)
- UV záření - přechody mezi vrstvami (10 - 390 nm)
- RTG záření - těžší atomy, velké energetické rozdíly mezi vrstvami (0,1 - 10 nm)
- Infračervené záření - přechod elektronů v molekulách (760 - 1000 nm)
Lasery
Každý atom vyzáří foton o energii při přechodu z vyššího (excitovaného) stavu do nižšího. K tomu může dojít dvojím způsobem:
- Nekoherentní záření - probíhá samovolně, dříve či později vyzáří foton (zahřáté těleso)
- Stimulace emisí - foton dopadá na elektron v excitovaném stavu, ten vyzáří další foton, fotony poté letí společně
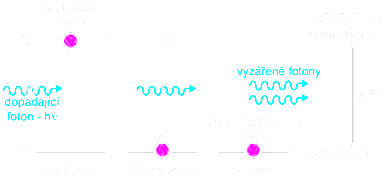
pokud mezi aktivní prostředí umístíme dvě zrcadla, tak se fotony budou odrážet a kumulovat
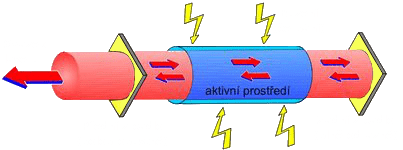
- Využití:
- medicína (laserový skalpel)
- přenos informací (holograf)
- RTG záření (rentgen)
