Elektrický proud v kapalinách a plynech
[Edit]Elektrický proud v kapalinách
- Elektrolýza – Látkové změny vyvolané při průchodu elektrického proudu elektrolytem na elektrodách
- Katoda – Spojená se zápornou svorkou zdroje napětí
- Anoda – Spojena s kladnou svorkou zdroje napětí
- Elektrolyty – Roztoky kyselin (), zásad (NaOH), solí (NaCl) a jejich taveniny, které vedou elektrický proud, vodivost elektrolytu způsobují kladné a záporné ionty (kationty a anionty)
-
Neelektrolyty – Látky, které se ve vodném roztoku nebo tavenině neštěpí na volně pohyblivé ionty, a proto nevedou elektrický proud
- Elektrolytická disociace – Rozpad látky na ionty
- Disociace kyseliny:
- Disociace zásady:
- Disociace soli:
| Příklad elektrolýzy |
|---|
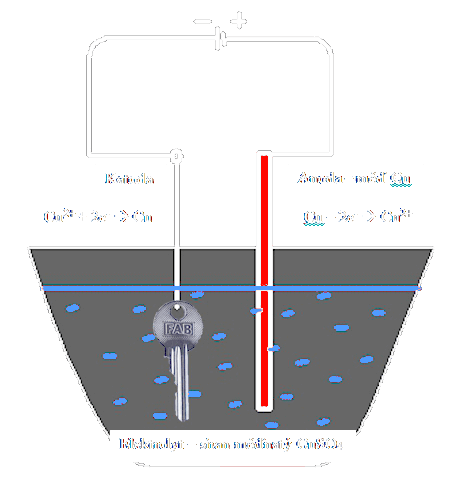 |
- Elektrolýza síranu měďnatého (modré skalice)
- Katoda (uhlíková) – Kationty přijímají dva elektrony, a vylučují se jako čistá (neutrální) měď
- Anoda (měděná) – anionty reagují s materiálem anody (mědí) a vytvářejí nové molekuly . Z anody přechází do roztoku právě tolik atomů mědi, kolik se jich vylučuje na katodě a koncentrace roztoku se nemění
Při elektrolýze se na katodě vždy vylučuje vodík nebo kov. Na anodě se také může vylučovat látka (kyslík v Hofmannově přístroji), může však také docházet jen k rozpouštění anody.
Faradayovy zákony
1. Faradayův zákon
Hmotnost vyloučené látky je přímo úměrná náboji , který prošel elektrolytem.
- [kg.C] - Elektrochemický ekvivalent látky, konstanta úměrnosti, která je pro danou látku charakteristická
- - Náboj
- - Proud procházející elektrolytem
- - Čas, po který proud procházel elektrolytem
2. Faradayův zákon
Elektrochemický ekvivalent látky vypočteme, jestliže její molární hmotnost vydělíme Faradayovou konstantou a počtem elektronů potřebných k vyloučení jedné molekuly.
- - Molární hmotnost látky
- - Faradayova konstanta, má hodnotu 9,64.10 mol
- - Počet elementárních částic potřebných k vyloučení atomu z elektrolytu
Voltampérová charakteristika elektrolytického vodiče
Vezměme si jako příklad roztok . Vložíme do tohoto roztoku dvě měděné elektrody, které budou nabité. Při zvyšování napětí nám bude konstantně růst i proud , platí tedy Ohmův zákon:
- - Odpor
Pokud si však vezmeme roztok a platinové elektrody, Ohmův zákon zde platí až po překročení tzv. rozkladného napětí .
Pro odpor elektrolýzy platí:
- - Měrný elektrický odpor (rezistivita), se stoupající teplotou klesá, neboť se snižuje vnitřní tření brzdící pohyb iontů v elektrolytu
- - Délka vodiče
- - Příčný průřez vodiče
Galvanické články
Galvanický článek je tvořený dvěma elektrodami z různých kovů, mezi kterými je umístěn elektrolyt. Využívá chemickou energii uvolněnou při reakci kovových elektrod s elektrolytem, která se přeměňuje na energii elektrickou.
-
Voltův článek – Nejjednodušší článek, tvoří ho zinková(-) a měděná(+) elektroda ponořená do zředěné kyseliny sírové, elektromotorické napětí mezi elektrodami je 1,1 V
-
Suchý článek (monočlánek) - Tvoří ho zinková nádoba a uhlíková tyčinka, obklopená směsí burelu a koksu, elektrolytem je roztok salmiaku zahuštěný škrobem U = 1,5 V
-
Akumulátor - Galvanický článek, který se dá opětovně nabíjet, je založen na vzniku elektrických potenciálů elektrod po proběhnutí vratných chemických dějů
Využití elektrolýzy
- V elektrometalurgii k získávání kovů z roztoků (hliník)
- V galvanostegii k pokovování
- V galvanoplastice k vytváření odlitků
- K výrobě elektrolytického kondenzátoru
Elektrický proud v plynech
- Plyny jsou tvořeny elektricky neutrálními molekulami, proto za běžných teplot a tlaků jsou dobrými elektrickými izolanty
- Aby mohl plyny procházet elektrický proud, musí plyn obsahovat volné částice s nábojem, a musí být v elektrickém poli
Ionizace
Plyny se stávají elektricky vodivými, působením plamene nebo zářením (ionizátory). Tím se molekuly plynu rozštěpí na elektron a kladný iont (kationt), elektrony se mohou zachytit na neutrálních molekulách a vzniknou záporné ionty (anionty). Energie potřebná k uvolnění elektronů se nazývá ionizační energie.
Rekombinace
Probíhá současně s ionizací uvnitř plynu, je to děj opačný k ionizaci. Nesouhlasně nabité částice se navzájem přitahují a vytvářejí opět neutrální molekuly. Nachází-li se ionizovaný plyn mezi nabitými deskami (elektrodami), dochází k pohybu iontů. Kationty jdou na katodu a anionty na anodu. Ty pak na elektrodách ztrácejí svůj náboj a stávají se neutrálními atomy.
Voltampérová charakteristika výboje
Při napětí (0 - ) převládá rekombinace, tzn. slučování elektronů s neutrálními molekulami, platí tedy Ohmův zákon (počet iontů, které předají náboj elektrodám, je přímo úměrný napětí).
Při napětí ( - ) se velká část elektronů nestihne rekombinovat (kvůli vysoké rychlosti) a doletí k anodě samostatně. V tento okamžik je mezi elektrodami nasycený plyn (Ionizátor už nemá dostatek energie na štěpení nových částic).
Při překročení napětí již není k pohybu iontů potřeba žádný ionizátor. Ionty se pohybují tak rychle, že jejich kinetická energie při srážce s molekulou stačí na rozštěpení této molekuly. Při tomto stavu vzniká tzv. samostatný výboj.
Plyn, ve kterém probíhá samostatný výboj se nazývá plazma, neboli vysoce ionizovaný plyn.
Samostatný výboj plynu za atmosférického tlaku
Obloukový výboj

- Zdroj světla - výbojky (sodíkové, xenonové, rtuťové)
- Probíhá při napětí kolem desítek voltů
Jiskrový výboj
- Krátkodobý
- Mezi dvěma nabitými deskami dojde k vyrovnání napětí (přeskočí jiskra).
- Tento děj je doprovázen zvukovým efektem
- Probíhá při napětí až miliony voltů
- Blesk- vyrovnání napětí mezi mrakem a zemi, nebo dvěma mraky

Koróna
- Trsovitý výboj
- Vzniká v nehomogenním elektrickém poli
- Například okolo drátů, hran a hrotů s vysokým potenciálem
- Eliášův oheň (příklad koróny) - Akustický a optický jev vyvolaný vybitím statické elektřiny. Při silných bouřích, ztráty elektrické energie v okolí drátů vysokého napětí

Samostatný výboj v plynu za sníženého tlaku
Doutnavý výboj
- Vzniká mezi elektrodami ve výbojové trubici za sníženého tlaku
- Doutnavky (výbojky plněné neonem) - Zdroj světla s malou spotřebou. Používají se, jako kontrolní světla (např. u rychlovarné konvice)
- Reklamní trubice (dnes už se používají led osvětlení)
 |
 |
Katodové záření
- Probíhá ve výbojové trubici za sníženého tlaku a vysokého napětí
